- Trang chủ
- Sách y học
- Bài giảng sinh lý bệnh
- Đại cương rối loạn cân bằng acid base
Đại cương rối loạn cân bằng acid base
Hầu hết các phản ứng chuyển hóa xảy ra trong cơ thể luôn đòi hỏi một pH thích hơp, trong khi đó phần lớn các sản phẩm chuyển hóa của nó.
Biên tập viên: Trần Tiến Phong
Đánh giá: Trần Trà My, Trần Phương Phương
Ý nghĩa của pH máu
Hầu hết các phản ứng chuyển hóa xảy ra trong cơ thể luôn đòi hỏi một pH thích hơp, trong khi đó phần lớn các sản phẩm chuyển hóa của nó lại có tính acid làm cho pH có khuynh hướng giảm xuống. Ví dụ: Sự oxy hóa hoàn toàn chất hydrat carbon và mỡ, mỗi ngày sinh ra khoảng 22.000 mEq CO2. CO2 hóa hợp với nước hình thành acid carbonic (H2CO3). Mặt khác còn có khoảng 70 mEq chất axid cố định (acid không bay hơi) hình thành từ các nguồn chuyển hóa khác: các axid hữu cơ (acid lactic, acid pyruvic, aceton) sinh ra từ sự oxy hóa không hoàn toàn chất hydrat carbon và mỡ và các acid cố định dưới dạng sulfat (từ oxy hóa các acid amin có chứa sulfua), nitrat và photphat (từ oxy hóa các phosphoprotein).
Tuy các chất chuyển hóa acid được hình thành một cách liên tục như vậy nhưng pH của các dịch hữu cơ vẫn ít thay đổi là nhờ cơ thể tự duy trì pH bằng các hệ đệm trong và ngoài tế bào, sự đào thải acid của phổi và thận:
Bằng hệ thống đệm huyết tương: Bao gồm hệ đệm HCO3-/H2CO3, hệ đệm proteine/proteinate và hệ đệm H2PO4-/HPO42-. Các hệ đệm này đảm nhiệm 47% khả năng đệm của toàn cơ thể.
Bằng hệ thống đệm của hồng cầu: Bao gồm hệ đệm Hemoglobinate/ Hemoglobine, hệ đệm HCO3-/H2CO3 và hệ đệm phosphate hữu cơ. Các hệ đệm này đảm nhiệm 53 % khả năng đệm còn lại của toàn cơ thể.
Đào thải acid bay hơi (CO2) qua phổi.
Đào thải acid không bay hơi qua thận.
Bởi vậy pH huyết tương tương đối hằng định và bằng 7,4 ± 0,05.
Khái niệm về pH và ion H+
Trong Y học và Sinh học người ta mô tả sự trao đổi chất acid và base theo khái niệm của Bronstedt. Acid được định nghĩa như là một chất có thể giải phóng ion H+, còn chất base là chất có thể tiếp nhận ion H+. Độ acid của một dung dịch được biểu thị bằng giá trị pH và bằng nghịch dấu logarit của hoạt tính proton:
pH = - logH+
Sự duy trì cân bằng acid-base trong giới hạn bình thường cũng chính là sự duy trì nồng độ ion H+ trong giới hạn bình thường. Dung dịch acid chứa một lượng ion H+ cao hơn so với lượng ion OH-, dung dịch base thì ngược lại, còn dung dịch trung tính lượng ion H+ và OH- tương dương nhau và bằng 10-7. Chỉ số nồng độ ion H+ và OH- trong dung dịch là một hằng số: [ H+]. [OH-] = 10-14.
Đối với nước nguyên chất, mức phân ly của ion H+ và OH- bằng nhau. Nồng độ ion H+ tính ra mEq/L là bằng 10-7 ở nhiệt độ 230C. Vậy pH của nước nguyên chất hay của các dung dịch trung tính bằng 7.
Tuy nhiên trong y học, thuật ngữ acid-base không được hiểu theo nghĩa hóa học tuyệt đối vì các dịch của cơ thể đều hơi kiềm. Nồng độ ion H+(aH+) trong huyết tương khoảng 0,0004 mEq/L = 4.10-5 mEq/L = 4.10-8 Eq/L.
Suy ra: pH máu = - log [H+]= -(log 4.10-8 ) = 7,398 hay theo phương trình Henderson-Haselbach:
pH = pK + log [HCO3-/H2CO3]= 6,1 + log 20/1 ≈ 6,1 + 1,3 ≈ 7,4
Trong cơ thể ion H+ tuần hoàn dưới hai hình thức:
Các ion H+ liên kết với các anion bay hơi (HCO3- ) chịu trách nhiệm chính về những rối loạn cân bằng acid-base kiểu hô hấp.
Các ion H+ liên kết với các anion cố định, không bay hơi (SO42-, PO43-, lactat,...) chịu trách nhiệm chính về những rối loạn cân bằng acid- base kiểu chuyển hóa.
Khái niệm về kiềm dư (BE: base excess)
Là lượng kiềm chênh lệch giữa kiềm đệm mà chúng ta đo được và kiềm đệm bình thường. Nó đặc trưng cho lượng kiềm thừa hoặc thiếu để máu bệnh nhân có thể trở về trạng thái cân bằng acid - base bình thường.
BE máu là nồng độ base của máu toàn phần được đo bởi chuẩn độ đối với một acid mạnh để pH bằng 7,4 ở PCO2 40mmHg và nhiệt độ 37oC. Đối với một chuẩn độ có giá trị âm thì được thực hiện với một base mạnh. BE được tính bằng mmol/l (hoặc mEq/l), nhằm để đo sự thừa hoặc thiếu H2CO3. Giá trị bình thường từ -1 đến +2 mmol/l và nó biểu thị cho khả năng cặn của đệm và được tính bằng:
BE = (HCO3- - 24,2 ) + 16,2 ( pH - 7,4)
Khi giá trị pH của một mẫu máu ở nhiệt độ 37oC có PCO2 là 40 mmHg bằng 7,4 và HCO3- bằng 24,2 mmol/l thì giá trị tham khảo của BE bằng 0 mmol/l . Khi giá trị pH của kết quả này dưới 7,4 thì BE sẽ âm và trên 7,4 thì BE sẽ dương.
16,2 mmol/l là khả năng đệm của đệm không phải bicarbonat trong dịch ngoại bào. BE là một chỉ số quan trọng trong rối loạn cân bằng acid- base. BE dương trong nhiễm toan hô hấp và nhiễm kiềm chuyển hóa. BE âm trong nhiễm toan chuyển hóa và nhiễm kiềm hô hấp.
Khái niệm về khoảng trống anion
Khoảng trống anion máu ( Anion Gap: AG )
Khoảng trống anion máu được coi là những anion không định lượng của huyết tương, bình thường khoảng 12-18mmol/l. Các anion không được định lượng bao gồm: anion Protein, các phosphat, các sulfat, các anion hữu cơ.
Công thức đơn giản để tính: AG = [Na+ - (Cl- + HCO3-)]
Khi các anion acid như acetoacetat và các lactat gia tăng trong dịch ngoại bào, khoảng trống anion tăng gây nhiễm toan với AG tăng.
Tăng AG: thường do tăng anion không định lượng được và rất ít gặp do giảm các cation không định lượng được (Ca++, Mg++, K+ ). AG cũng có thể tăng với tăng anion albumin, hoặc do tăng nồng độ albumin, hoặc do nhiễm kiềm làm thay đổi điện tích albumin.
Giảm AG: có thể do:
Tăng các cation không định lượng được.
Hiện diện trong máu các cation bất thường như lithium (nhiễm độc lithium) hoặc cation immunoglobulin (gặp trong bệnh loạn tương bào).
Giảm trong huyết tương anion albumin (hội chứng thận hư).
Giảm điện tích hiệu quả anion của albumin bởi nhiễm toan.
Bệnh nhầy nhớt và tăng lipid máu nặng.
Khi albumin máu bình thường, AG tăng thường là do sự hiện diện của acid không chứa Cl- như các anion: không phải hữu cơ ( photphat, sulfat ), hữu cơ: ketosis, lactate, các anion hữu cơ urê, ngoại sinh( salicylat hoặc nhiễm độc những sản phẩm acid hữu cơ) hoặc không xác định được.
Theo định nghĩa nhiễm toan AG tăng có 2 đặc tính: HCO3- giảm và AG tăng
Khái niệm về khoảng trống anion niệu( UAG: Urine Anion Gap)
Khoảng trống anion niệu được tính bằng: UAG = [(Na+ + K+ ) / niệu - ( Cl- )/ niệu].
Khoảng trống anion niệu cho phép người ta ước tính được nồng độ NH4+ niệu. NH4+ có thể xem như một chất kiềm hữu cơ có khả năng trung hòa acid mà không cần tới Na+, K+. Vì vậy nồng độ NH4+ niệu nói lên khả năng đệm của thận. Khi ( Cl- )/niệu > (Na+ + K+) / niệu thì NH3+ niệu sẽ được tăng lên theo phương thức thích hợp, gợi ý một nguyên nhân nhiễm toan ngoài thận. Thật vậy trong ỉa lỏng, do mất HCO3- qua phân nên đưa đến nhiễm toan chuyển hóa. Thay vì pH nước tiểu acid (như trong nhiễm toan hệ thống), pH nước tiểu acid thường chung quanh 6 vì nhiễm toan chuyển hóa và giảm K+ máu làm tăng tổng hợp và bài tiết NH4+qua thận; như thế gây ra một đệm nước tiểu làm tăng pH nước tiểu. Như vậy sự bài tiết NH4 qua nước tiểu tăng cao trong ỉa lỏng và thấp trong nhiễm toan do ống thận(RTA: renal tubular acidosis). Những bất thường trong nhiễm toan do ống thận xa cổ điển (type I) là giảm K+ máu, nhiễm toan tăng Cl-, giảm bài tiết NH4+ qua nước tiểu(UAG +, NH4+ niệu giảm) và pH niệu tăng theo phương thức không thích hợp (pH > 5,5). Bệnh nhân này không có khả năng toan hóa nước tiểu của họ xuống dưới 5,5. Thường có giảm citrat niệu, tăng calci niệu đưa đến rỗ xương. Trong RTA type IV, tăng K+ máu không tỷ lệ với so với giảm GFR do cùng tồn tại rối loạn chức năng bài tiết K+ và acid.
Các hệ thống điều hòa pH
Điều hòa do hệ thống đệm
Nguyên tắc hoạt động:
Một hệ thống có khả năng giữ cho pH của dung dịch ít thay đổi khi cho thêm vào dung dịch ion H+ hoặc OH- thì gọi là hệ thống đệm. Hệ thống này bao giờ cũng có đủ hai thành phần: một acid yếu và một muối của base mạnh hoặc một base yếu với muối của nó với một acid mạnh. Ví dụ hệ đệm bicarbonat gồm H2CO3/ NaHCO3 (acid yếu: H2CO3) /muối của base mạnh: NaOH), hệ đệm NH4OH/NH4Cl (base yếu: NH4OH/muối của acid mạnh: HCl).
Tính chất hoạt động của hệ đệm phụ thuộc vào mức độ phân ly của nó trong dung dịch. Mỗi hệ thống đệm đều có một hằng số phân ly riêng và được thể hiện bằng logarit trái dấu tức pK. PK càng nhỏ thì càng dễ phân ly và ngược lại, hệ đệm nào có pK càng gần pH thì hoạt động càng có hiệu quả.
Trong một hệ thống đệm nhất định khi lượng ion H+ phân ly và lượng ion H+ kết hợp bằng nhau và bằng 50% thì người ta nhận thấy pH của hệ đệm không thay đổi nên gọi là pK của hệ thống ấy (tức pH = pK) .
Theo phương trình Henderson - Hassenbach:
pH = pK + log [ A- / A- H+ ]
A là hình thái kết hợp, A- H+ là hình thái phân ly của hệ đệm.
Các hệ thống đệm chính:
Hệ đệm bicarbonat: NaHCO3/H2CO3 = HCO3- / HCO3- H+:
Hệ đệm này đảm nhiệm 43% khả năng đệm của toàn cơ thể, trong đó ngoại bào 33% và nội bào 10%. Đây là một hệ đệm rất quan trọng và rất linh hoạt, là hệ đệm chính của ngoại bào vì:
Nồng độ ion bicarbonat dưới hình thái kết hợp NaHCO3 trong huyết tương cao. Bình thường nó được thận đào thải hoặc tái hấp thu thường xuyên để có nồng độ ổn định trong huyết tương là 27 mEq/L (còn gọi là dự trữ kiềm).
Acid carbonic là một acid bay hơi có thể tăng giảm nồng độ một cách nhanh chóng nhờ hoạt động của phổi (tăng hoặc giảm thông khí) để có nồng độ ổn định trong huyết tương là 1,35 mEq/L.
Theo phương trình Henderson-Haselbach:
pH = pK + log [ NaHCO3/H2CO3] = pK + log HCO3-/aPCO2
= 6,1 + log 27/1,25 = 6,1 + log 20 ≈ 6,1 + 1,3 ≈ 7,4
Như vậy, sau khi hệ bicarbonat đã đệm rồi thì pH của dịch ngoại bào cũng chỉ giao động chung quanh 7,4 mà thôi.
Hệ đệm photphat: Na2HPO4/NaH2PO4 = NaHPO4-/NaHPO4-H+
Đảm nhiệm 7% khả năng đệm của cơ thể, là một hệ đệm của nội bào (PO43- nội bào = 140 mEq/L) và của nước tiểu, có hiệu suất lớn vì pK bằng 6,8 gần với pH sinh lý.
Hệ đệm proteine/proteinate:
Đây cũng là một hệ thống đệm của huyết tương, đảm nhiệm 12% khả năng đệm của cơ thể. Hệ đệm proteinat bằng các gốc amin và gốc carboxyl của nó( NH3+ - R- COO-).
Ở điểm đẳng điện, số điện tích dương và âm bằng nhau. Thêm ion H+, protein sẽ tích điện dương và chuyển sang phía acid của điểm đẳng điện. Khi mất H+, protein tích điện âm và chuyển sang phía base của điểm đẳng điện. Như vậy trong môi trường acid, protein thể hiện tính kiềm và ngược lại.
Hệ đệm Hemoglobinate/ Hemoglobine:
Gồm hệ hemoglobinat Hb-/Hb- H+ và Oxy hemoglobinat HbO-/HbO- H+.
Đây là hệ đệm của hồng cầu, có hàm lượng rất lớn nên chúng có vai trò quan trọng trong điều hòa pH máu qua sự bắt giữ và đào thải CO2 ở phổi. Hệ đệm này đảm nhiệm 36% khả năng đệm của toàn cơ thể.

Bảng: Hoạt tính của các hệ đệm (%) trong điều hòa cân bằng acid- base.
Tóm lại, các hệ thống đệm của cơ thể can thiệp rất sớm vào việc duy trì cân bằng acid - base trong giới hạn bình thường mà hiệu quả đệm phụ thuộc chủ yếu vào hệ đệm bicarbonat (qua hệ đệm này, hiệu lực của các hệ đệm khác cũng được phản ảnh đúng, vì vậy các tính toán chủ yếu là suy luận trên hệ đệm bicarbonat). Các thành phần của hệ đệm bị hao hụt do tác dụng trung hòa sẽ được tái phục hồi nhờ vào những hoạt động tích cực của phổi và thận.
Điều hòa do hô hấp
Khi cơ thể tích nhiều CO2 sẽ làm pH giảm, pH giảm tới 7,33 là trung tâm hô hấp bị kích thích mạnh dẫn tới tăng thông khí, nhờ vậy CO2 được đào thải ra ngoài cho tới khi tỉ lệ H2CO3 trên NaHCO3 trở về giá trị 1/20. Ngược lại khi H2CO3 giảm hoặc NaHCO3 tăng , pH sẽ có xu hướng tăng thì trung tâm hô hấp sẽ bị ức chế dẫn tới thở chậm, CO2 tích lại cho đến khi tỷ số nâng lên đến 1/20. Dĩ nhiên để bảo đảm đào thải CO2 được tốt thì không những hoạt động của trung tâm hô hấp mà cả hệ hô hấp và tuần hoàn cũng như số lượng và chất lượng Hb cũng phải bình thường.
Trung tâm hô hấp rất nhạy cảm với nồng độ CO2 trong máu: một sự gia tăng 0,3% pCO2 trong máu động mạch sẽ làm tăng tần số hô hấp lên gấp đôi và ngược lại nếu pCO2 giảm thì tần số hô hấp giảm. Điều hòa hô hấp là bảo vệ đầu tiên của cơ thể nhằm hạn chế các biến thiên của pH máu bằng cách thay đổi tỷ lệ acid carbonic trong máu qua sự tăng hay giảm thông khí phổi được điều khiển bởi trung tâm hô hấp và bởi các thụ thể hoá học.
Cần lưu ý rằng áp lực riêng phần của CO2 trong phế nang bằng với áp lực riêng phần của nó trong máu động mạch vì CO2 từ máu tĩnh mạch đến phổi khuyếch tán rất nhanh qua màng phế nang và có xu hướng cân bằng áp lực ở hai bên màng. Người ta còn dùng pCO2 để biểu thị cho nồng độ H2CO3 trong máu vì khi CO2 vào máu ngay lập tức sẽ bị hydrat hóa thành acid carbonic: CO2 + H2O ⇒ H2CO3(mmol/L) = a.pCO2 (mmHg)
a là hệ số hòa tan và bằng 0,0308
Từ phương trình Henderson-Hasselbach ( pH = 6,1 + log [HCO3/a.pCO2]) ta thấy pH phụ thuộc vào tỷ lệ HCO3-/a.pCO3
Trong nhiễm acid chuyển hóa, NaHCO3 giảm; để hạn chế sự dao động của pH, hô hấp sẽ điều hòa bằng cách tăng thông khí để tăng thải CO2 với mục đích giảm H2CO3 trong máu để giữ tỷ HCO3-/H2CO3 không đổi (20/1) , điều nầy có nghĩa là sẽ giữ được pH không đổi.
Trong nhiễm base chuyển hóa, NaHCO3 tăng. Hô hấp sẽ điều hòa bằng cách giảm thông khí nhằm giữ CO2 để tăng H2CO3 trong máu nhằm giữ tỷ HCO3-/ H2CO3 không đổi (20/1). Như thế sẽ giữ pH ít bị thay đổi.
Lượng CO2 do tế bào sinh ra khoảng 800-900g mỗi ngày cùng với lượng H2CO3 sinh ra do phản ứng đệm sẽ được hệ thống đệm Hb của hồng cầu phối hợp với hệ bicarbonat làm trung hòa và đem thải qua phổi.
Cơ chế kết hợp và phân ly của CO2 và O2 với Hb dựa vào tính chất acid của HHb, H2CO3 và HHbO2 không được ngang bằng với nhau, trong đó HHb < H2CO3 < HHbO2 về tính acid. Do vậy, then chốt trong sự đệm này là tính acid mạnh của HHbO2 làm cho nó có thể đẩy được H2CO3 ra khỏi muối kiềm của nó (KHCO3) do hồng cầu mang từ tổ chức đến phổi và phân ly thành CO2 đào thải qua phế nang. Từ đó HHbO2 dưới dạng muối kiềm (KHbO2) sẽ được hồng cầu mang đến tổ chức và ở đó, do pCO2 giảm nên phân ly thành KHb và O2. O2 đi vào tế bào đồng thời CO2 từ tổ chức vào hồng cầu tạo H2CO3 kết hợp với KHb thành HHb và KHCO3, chất nay` phân ly cho HCO3- ra huyết tương và nhận Cl- vào hồng cầu làm pH máu tăng (ở phổi quá trình nay` diễn tiến ngược lại).
Sự điều hòa của hô hấp là tiền đề bước đầu nhưng về sau là sự điều hòa hiệu quả của thận.
Điều hòa do thận
Thận không tham gia chống lại tình trạng rối loạn cân bằng acid - base ngay từ lúc ban đầu mà chỉ sau nhiều giờ thận mới tự điều chỉnh. pH chỉ thực sự trở về sinh lý bình thường sau khi đã có sự điều chỉnh của thận. Bình thường thận có thể bài xuất hoặc giữ một cách rất uyển chuyển ion H+ cũng như các ion khác. Ta biết một chế độ ăn bình thường sẽ sản xuất các acid thừa (thừa ion H+) làm tăng độ acid của nước tiểu lên một cách nguy hiểm. Mặt khác, nếu lượng acid thừa này được bài xuất dưới dạng muối natri trung tính thì cơ thể sẽ mất nhanh chóng cation chính của dịch ngoại bào hệ quả sẽ làm giảm thể tích ngoại bào. Vì vậy, thận phải nhờ các cơ chế ưu việt khác để bài xuất các acid thừa ra khỏi cơ thể.
Thận thải chất acid thừa
Khi nhiễm acid thận điều hòa bằng cách bài xuất ion H+, giữ lại các cation kiềm (K+, Na+) và anion đệm (H2CO3-). Trong những điều kiện bình thường thận có thể bài xuất từ 50-70 mEq H+ trong 24 giờ và làm cho pH của nước tiểu giảm xuống đến 4,5 bằng cách:
Thải H+ dưới dạng acid chuẩn độ:
Thận thay thế các ion Na+ bằng các ion H+ của phân tử Na2HPO4 thành NaH2PO4 tức bài xuất photphat dưới dạng trạng thái nhiễm acid (monosodic phosphate) thay cho photphat dưới dạng kiềm (disodic phosphate). Tính acid chuẩn độ là số lượng ion H+ đã bài xuất thay cho Na+ từ Na2HPO4 và đo lường theo cách chuẩn độ nước tiểu bằng dung dịch natri dexinoman (N/10) và đưa pH nước tiểu lên bằng pH máu (7,4).
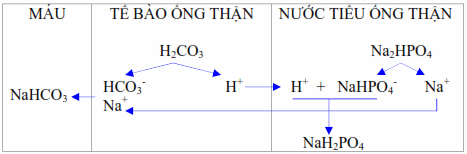
Hình. Thận thải H+ dưới dạng axit chuẩn độ.
Lượng ion H+ bài xuất dưới dạng này chiếm khoảng 1/3 lượng H+ cần đào thải.
Thải H+ dưới dạng ion amoni (NH4 +).
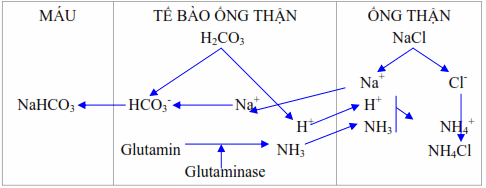
Hình: Thận thải H+ dưới dạng ion amoni.
Ở các tế bào ống góp và ống xa tạo ra 30-50 mEq NH3 mỗi ngày từ glutamine, alanin, histidin. Amoniac khuếch tán vào trong nước tiểu acid, tại đây NH3 biến đổi thành ion NH4+ nhờ kết hợp với một ion H+. Do ion NH4+ không khuếch tán qua màng sinh học nên chúng không thể khuếch tán ngược trở lại vào tế bào ống thận và được bài xuất thay thế cho các ion Na+, K+.
Lượng H+ được bài xuất dưới dạng này chiếm đến 2/3 lượng H+ cần đào thải.
Tái hấp thu hoàn toàn Natri bicarbonat:
Số lượng ion HCO3- do cầu thận lọc ra được hấp thu vào các ống thận đạt tới khoảng 28 mEq/l. Trong các tế bào ống thận, acid carbonic bị ion hóa thành H+ và HCO - . H+ được đào thải qua nước tiểu trao đổi với Na+ theo cơ chế một đổi một nhờ vậy mà tái lập được dự trữ kiềm cho cơ thể.
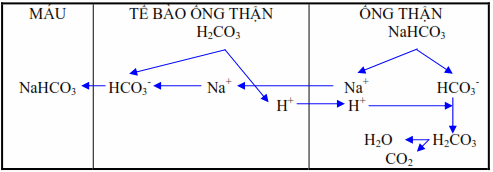
Hình: Thận tái hấp thu hoàn toàn Natri bicarbonat.
Enzym carbonic anhydrase có vai trò quyết định sự hydrat hóa CO2 thành H2CO3 trong tế bào ống thận. Trong nước tiểu thì ngược lại, H2CO3 bị phân ly thành CO2 và H2O, nhờ phản ứng này nên cản trở được sự tích lũy H+ trong nước tiểu ống lượn gần tạo điều kiện cho sự trao đổi giữa các ion H+ và giữa các gradient thấp của H+. Ở cuối ống lượng gần, NaHCO3 được hấp thu với tỷ lệ 90% so với NaHCO3 được lọc và ở ống lượng xa, lượng NaHCO3 đã bị hạ thấp này lại còn được tiếp tục tái hấp thu nữa.
Thận thải chất base thừa
Thận có xu hướng sửa chữa trạng thái nhiễm base bằng cách bài xuất ion HCO3- làm cho pH của nước tiểu kiềm hóa đến mức 7,8 bằng cách:
Ức chế hiện tượng tái hấp thu NaHCO3 ở ống thận.
Thải phophat dưới dạng Na2HPO4.
Giảm tạo ion NH4+.
Điều hòa do trao đổi ion giữa nội và ngoại bào
Các cation
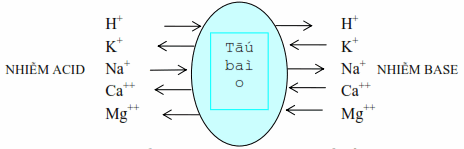
Hình: Trao đổi ion giữa nội và ngoại bào để điều hoà pH.
Sự quá tải ion H+ của dịch ngoại bào có xu hướng được bù bởi sự di chuyển của H+ từ khu vực ngoại bào sang khu vực nội bào, ở đây H+ được bắt giữ bởi các chất đệm, đồng thời hoán đổi với Na+ và K+ từ nội ra ngoại bào làm tăng K+ máu do chuyển vận. Cứ 3 ion K+ giải phóng từ tế bào ra sẽ được thay thế bằng 2 ion Na+ và 1 ion H+. Ngược lại, khi bị nhiễm base, H+ ra khỏi nội bào hoán đổi với Na+ và K+ làm giảm K+ máu. Những trao đổi ion nầy rất nghiêm ngặt thể hiện qua mối tương quan rõ rệt giữa những thay đổi nồng độ K+ và biến đổi pH của ngoại bào. Mọi sự gia tăng pH thêm 0,1 đơn vị kéo theo một sự sút giảm từ 0,5-0,7 mEq/L kali và ngược lại.
Các anion
Việc CO2 vào hồng cầu có kèm sự di chuyển của HCO3+ từ hồng cầu sang huyết tương còn Cl- thì từ huyết tương đi vào hồng cầu (hiện tượng Hamberger). Cơ chế là do CO2 khi vào hồng cầu nhờ enzym carbonic anhydrase hydrat hóa thành H2CO3 rồi phân ly thành H+ và HCO - . Ion H+ dược Hb đệm, trong khi HCO3- ra lại huyết tương 70% do sự chên lệch về nồng độ nhưng vì gặp phải sức hút của những cation trong hồng cầu nên nó chỉ được ra khỏi hồng cầu khi có một số lượng tương đương Cl- từ huyết tương vào thay thế cho nó để cân bằng điện tích. Điều này giải thích tại sao Cl- máu tĩnh mạch thấp và hồng cầu ở tĩnh mạch lại to hơn (do có nhiều ion nên hồng cầu tăng giữ nước và trương lên).
Bài viết cùng chuyên mục
Một số chỉ định điều trị shock
Bởi vì tác động có hại chính của hầu hết các loại shock là phân phối quá ít oxy đến các mô, việc cho bệnh nhân thở oxy có thể có lợi trong một số trường hợp.
Định lượng nồng độ hormone trong máu
Phương pháp rất nhạy đã định lượng các hormone, tiền thân của chúng và sản phẩm chuyển hóa của chúng, bổ sung thêm nhiều phương pháp, như xét nghiệm miễn dịch gắn enzyme.
Thay đổi trong quá trình lão hoá
Tuyến ức liên tục giảm kích thước và chức năng ngay từ khi cơ thể còn trẻ, đến tuổi trung niên thì thoái hoá hẳn
Tổng hợp ADH ở vùng dưới đồi và giải phóng từ thùy sau tuyến yên
Sự bài tiết ADH để đáp ứng với kích thích thẩm thấu là nhanh chóng, vì vậy nồng độ ADH huyết tương có thể tăng nhiều lần trong vòng vài phút, do đó cung cấp một phương thức thay đổi sự bài xuất nước qua thận của.
Nhu cầu Vitamins của cơ thể
Vitamin là một hợp chất hữu cơ với số lượng nhỏ cần thiết cho chuyển hóa bình thường mà cơ thể không tự tổng hợp được, sự thiếu hụt vitamin trong khẩu phần có thể gây ra những rối loạn chuyển hóa nghiêm trọng.
Rối loạn dạ dày trong quá trình tiêu hóa
Viêm dạ dày thường gây ra bởi sự nhiễm khuẩn mạn tính niêm mạc dạ dày, tình trạng này có thể chữa khỏi hoàn toàn bới một liệu trình kháng sinh cường độ lớn.
Aldosterone: vai trò trong việc kiểm soát bài tiết của thận
Trong trường hợp hoàn toàn không có aldosterone, tình trạng suy giảm thể tích có thể nghiêm trọng trừ khi người đó được phép ăn nhiều muối và uống nhiều nước để cân bằng lượng muối và nước trong nước tiểu tăng lên.
Chống đông: các chất sử dụng ngoài cơ thể
Bất kì chất nào làm mất đi dạng ion của calci máu đều có thể ngăn ngừa quá trình đông máu. Ion citrat tích điện âm là rất phù hợp và thường được hòa trộn với máu ở dạng natri citrat, amoni citrat hoặc kali citrat.
Giải phẫu sinh lý của thận và hệ tiết niệu
Mặt giữa của mỗi quả thận chứa một vùng rốn, qua đó đi qua động mạch thận và tĩnh mạch, bạch huyết, cung cấp thần kinh và niệu quản, nơi mang nước tiểu cuối cùng từ thận đến bàng quang.
Đời sống của bạch cầu: thời gian trong máu tuần hoàn và trong mô
Đời sống bạch cầu sau khi rời khỏi tủy xương thường là 4-8h trong máu tuần hoàn và khoảng 4-5 ngày trong các mô cần chúng. Trong các nhiễm khuẩn nghiêm trọng ở mô, đời sống thường bị rút ngắn chỉ còn vài giờ.
Cơ chế myogenic tự điều chỉnh lưu lượng máu qua thận và mức lọc cầu thận
Mặc dù cơ chế myogenic hoạt động ở hầu hết các tiểu động mạch đi khắp cơ thể, tầm quan trọng của nó trong lưu lượng máu thận và mức lọc cầu thận tự điều đã được đề cập.
Bệnh thận mạn: vòng xoắn bệnh lý dẫn đến bệnh thận giai đoạn cuối
Biện pháp hiệu quả nhất để làm chậm lại quá trình suy giảm chức năng thận này là giảm huyết áp động mạch và giảm áp lực ở cầu thận, đặc biệt bằng việc sử dụng các thuốc như ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin II.
Cơ chế bệnh sinh của loét dạ dày tá tràng
Nguyên nhân thông thường của loét đường tiêu hóa là sự mất cân bằng giữa tốc độ bài tiết dịch vị và các yếu tố bảo vệ bao gồm lớp hàng rào niêm mạc dạ dày - tá tràng và là sự trung hòa của acid dịch vị và dịch tá tràng.
Sinh lý bệnh của suy thượng thận và bệnh lý Addison
Lượng lớn của glucocorticoid đôi khi tiết ra để đáp ứng với các loại stress về thể chất hoặc tinh thần, bệnh Addison, đầu ra của glucocorticoid không tăng trong khi bị stress.
Bệnh tim bẩm sinh: huyết động học bất thường thường gặp
Ảnh hưởng của các tổn thương tim khác nhau có thể dễ dàng hiểu được. Ví dụ, hẹp van động mạch chủ bẩm sinh gây ra các tác động tương tự như hẹp van động mạch chủ do các tổn thương van tim khác gây ra.
Đông máu cầm máu: các xét nghiệm sử dụng trong lâm sàng
Máu lấy từ bệnh nhân ngay lập tức hòa trộn với oxalat nên không xảy ra quá trình chuyển hóa prothrombin thành thrombin. Sau đó, một lượng lớn ion calci và yếu tố mô nhanh chóng được hòa trộn với máu có oxalat.
Cơ chế bệnh sinh của gầy mòn chán ăn và suy nhược
Kho dự trữ chất béo hoàn toàn cạn kiệt, và chỉ còn nguồn năng lượng duy nhất là protein, thời điểm này, kho protein dự trữ một lần nữa bước vào giai đoạn suy giảm nhanh chóng.
Bất thường lâm sàng của điều chỉnh thể tích dịch: hạ và tăng natri máu
Hạ Na còn có thể do cơ thể hấp thu quá nhiều nước do tiết quá nhiều ADH, một hoocmon chống bài niệu, gây tái hấp thu quá nhiều nước vào cơ thể.
Nồng độ kali: điều chỉnh nồng độ trong dịch ngoại bào và bài tiết
Duy trì sự cân bằng giữa lượng kali ăn vào và ra phụ thuộc chủ yếu vào sự bài tiết qua thận vì lượng bài tiết qua phân chỉ chiếm khoảng 5 đến 10 phần trăm lượng kali ăn vào.
Cơ chế thận bài tiết nước tiểu pha loãng
Qúa trình pha loãng đạt được bằng cách tái hấp thu các chất tan đến một mức độ lớn hơn so với nước, nhưng điều này chỉ xảy ra trong các phân đoạn nhất định của hệ thống ống thận.
Bài tiết natri: điều chỉnh bằng mức lọc cầu thận hoặc tái hấp thu ở ống thận
Tái hấp thu ống và mức lọc cầu thận thường được điều chỉnh một cách chính xác, vì vậy sự bài tiết qua thận có thể khớp chính xác với lượng nước và chất điện giải.
Macula Densa natri clorua giảm gây ra sự giãn nở của các tiểu động mạch liên quan và tăng giải phóng Renin
Renin giải phóng từ các tế bào này sau đó có chức năng như một loại enzyme để tăng sự hình thành của angiotensin I, được chuyển thành angiotensin II.
Lưu lượng máu qua thận và sự tiêu thụ ô xy
Trong mỗi gram trọng lượng cơ bản, thận bình thường tiêu thụ oxygen tốc độ gấp đôi so với não nhưng có gấp 7 lần dòng chảy của não.
Tuổi già và bệnh tật
Các bệnh này hoặc mới mắc hoặc mắc từ trẻ nay nặng lên. Trên thực tế, số người chết thuần tuý do già là rất hiếm.
Phân tích biểu đồ suy tim mất bù
Điều trị bệnh tim mất bù cho thấy tác dụng của digitalis trong việc nâng cao cung lượng tim, do đó làm tăng lượng nước tiểu và dịch chuyển dần dần của đường hồi lưu tĩnh mạch sang trái.
