- Trang chủ
- Sách y học
- Bài giảng sinh lý bệnh
- Tổng hợp hemoglobin: gắn kết ô xy và thải trừ CO2
Tổng hợp hemoglobin: gắn kết ô xy và thải trừ CO2
Hemoglobin là có khả năng gắn không bền và thuận nghịch với phân tử oxi. Khả năng này liên quan đến hô hấp bởi vì chức năng cơ bản của hemoglobin là gắn với oxi tại phổi và giải phóng chúng tại mao mạch mô ngoại vi.
Biên tập viên: Trần Tiến Phong
Đánh giá: Trần Trà My, Trần Phương Phương
Quá trình tổng hợp hemoglobin bắt đầu từ giai đoạn tiền nguyên hồng cầu cho đến giai đoạn hồng cầu lưới. Do đó, khi hồng cầu lưới rời tủy xương vào máu, chúng vẫn tổng hợp một lượng rất nhỏ trong ngày kế tiếp hoặc đến khi chúng trở thành hồng cầu trưởng thành.
Hình trình bày sơ đồ hóa học tổng hợp hemoglobin. Đầu tiên, succinyl-CoA (được tổng hợp trong chu trình Krebs) phản ứng với glycine tạo pyrrole. Tiếp theo, 4 phân tử pyrrole kết hợp tạo ra protoporphyrin IX, sau đó gắn thêm sắt vào tạp ra nhân heme. Cuối cùng, mỗi nhân heme gắn với một chuỗi polypeptide dài, là một phân tử globin được tổng hợp tại ribosome, tạo thành 1 tiểu phần của hemoglobin gọi là chuỗi hemoglobin. Mỗi chuỗi nặng khoảng 16000; 4 chuỗi này liên kết không bền tạo ra một phân tử hemoglobin.
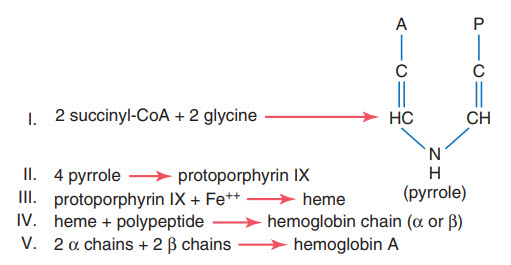
Hình. Hình thành huyết sắc tố (hemoglobin).
Có sự khác nhau giữa các dưới đơn vị chuỗi hemoglobin, phụ thuộc vào thành phần acid amin của đoạn polypeptide. Có 4 chuỗi khác nhau đã được gọi tên là α, β, gama và delta. Hemoglobin phổ biến nhất ở cơ thể người là hemoglobin A, tạo thành bởi 2 chuỗi α và 2 chuỗi β, nặng 64458 Da.
Mỗi chuỗi hemoglobin có 1 nhân heme gắn 1 nguyên tử sắt, có 4 chuỗi trong 1 phân tử do đó có 4 nguyên tử sắt trong phân tử hemoglobin. Mỗi nguyên tử sắt gắn với 1 phân tử oxi do đó 1 phân tử hemoglobin có thể vận chuyển 4 phân tử oxi (hay 8 nguyên tử oxi).
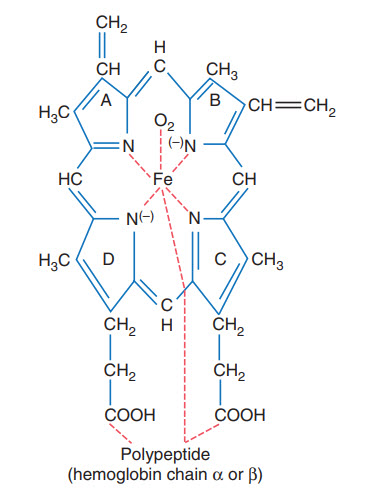
Hình. Cấu trúc cơ bản của gốc heme, cho thấy một trong bốn chuỗi heme liên kết với nhau, cùng với polypeptit globin, để tạo thành phân tử hemoglobin.
Loại chuỗi hemoglobin quyết định tính gắn với oxi của phân tử hemoglobin. Bất thường ở chuỗi cũng dẫn đến bất thưởng trong đặc điểm vật lý của phân tử. Ví như, trong thiếu máu hồng cầu hình liềm, amino acid glutamic bị thay thế bởi valin tại một vị trí trong cả hai chuỗi β. Khi hemoglobin này không gắn với oxi, nó tạo ra tinh thể dài bất thường dài khoảng 15 micrometers. Những tinh thể này làm tế bào hồng cầu gần như không thể đi qua các mao mạch nhỏ, và cực nhọn của các tinh thể này sẽ làm rách màng tế bào hồng cầu gây nên bệnh thiếu máu hồng cầu hình liềm.
Hemoglobin gắn thuận nghịch với oxygen. Đặc điểm quan trọng nhất của phân tử hemoglobin là có khả năng gắn không bền và thuận nghịch với phân tử oxi. Khả năng này liên quan đến hô hấp bởi vì chức năng cơ bản của hemoglobin là gắn với oxi tại phổi và giải phóng chúng tại mao mạch mô ngoại vi một cách dễ dàng, với áp lực khí ở đây thấp hơn rất nhiều ở phổi.
Oxi không gắn với vị trí 2 liên kết dương của nguyên tử sắt mà gắn lỏng lẻo với một trong các liên kết phối trí của nguyên tử sắt. Liên kết này rất lỏng lẻo nên có thể bị phá vỡ dễ dàng. Thêm vào đó, oxi không bị ion hóa mà vẫn giữ nguyên dạng đến khi nó được giải phóng, vào mô nó tồn tại ở dạng phân tử nhiều hơn.
Bài viết cùng chuyên mục
Hồng cầu máu: nồng độ hình dạng kích thước và chức năng
Các tế bào hồng cầu có chức năng khác ngoài vận chuyển hemoglobin, nó chứa một lượng lớn carbonyc anhydrase, một enzyme xúc tác cho phản ứng thuận ngịch giữa CO2 và nước tạo ra carbonic acid (H2CO3), làm tăng tốc độ phản ứng.
Hệ thống đệm photphat mang H + dư thừa vào nước tiểu và tạo ra HCO3− mới
Trong điều kiện bình thường, phần lớn các phosphate được tái hấp thu và chỉ khoảng 30-40 mEq/ngày dành cho đệm H+. Do đó, phần lớn các bộ đệm với H+ dư trong dịch toan ở ống thận xảy ra thông qua hệ đệm ammoniac.
Nhu cầu Vitamins của cơ thể
Vitamin là một hợp chất hữu cơ với số lượng nhỏ cần thiết cho chuyển hóa bình thường mà cơ thể không tự tổng hợp được, sự thiếu hụt vitamin trong khẩu phần có thể gây ra những rối loạn chuyển hóa nghiêm trọng.
Sự tái hấp thu ở ống thận: lớn về mặt định lượng và có tính chọn lọc cao
Đối với nhiều chất, tái hấp thu ở ống thận đóng một vai trò quan trọng hơn nhiều bài tiết trong việc xác định tỉ lệ bài tiết cuối cùng trong nước tiểu.
Đau tạng: cơ chế và đặc điểm phân biệt với cơn đau từ bề mặt da
Bất kỳ kích thích nào gây hưng phấn những đầu tận sợi dẫn truyền đau trong vùng mơ hồ của tạng cũng có thể tạo ra một cơn đau tạng.
Suy tim cấp: những thay đổi huyết động học
Nhiều người đặc biệt là người già có cung lượng tim khi nghỉ ngơi bình thường nhưng có tăng nhẹ áp lực nhĩ phải do mức độ bù của suy tim.
Tuần hoàn ngoài cơ thể: sử dụng trong phẫu thuật tim
Các hệ thống khác nhau đều gặp rất nhiều khó khăn, bao gồm tan máu, phát triển các cục máu đông nhỏ trong máu, khả năng các bong bóng oxy nhỏ hoặc các khối đệm nhỏ của chất chống tạo bọt đi vào động mạch.
Kiểm soát tuần hoàn thận của hormon và các chất hóa học
Trong trạng thái căng thẳng, chẳng hạn như sự suy giảm khối lượng hoặc sau khi phẫu thuật, các thuốc kháng viêm không steroid như aspirin, ức chế tổng hợp prostaglandin có thể gây ra giảm đáng kể mức lọc cầu thận.
Phân loại và đặc điểm của đau: đau nhanh và đau chậm
Đau được phân thành hai loại chính: đau nhanh và đau chậm. Đau nhanh được cảm nhận thấy trong vòng khoảng 0.1 giây sau khi một kích thích đau được gây ra, trong khi đau chậm bắt đầu chỉ sau 1 giây hoặc hơn.
Bạch cầu ưa acid (bạch cầu ái toan): chống lại nhiễm kí sinh trùng và dị ứng
Bạch cầu ái toan cũng có xu hướng đặc biệt tập trung nhiều trong các mô có phản ứng dị ứng, như trong các mô quanh phế quản ở người bị hen phế quản và trong da sau khi có phản ứng dị ứng da.
Các giai đoạn cầm máu: ngăn mất máu khi mạch máu bị tổn thương
Cơ chế tạo nút tiểu cầu cực kì quan trọng để sửa chữa hàng ngàn lỗ tổn thương xảy ra hàng ngày ở các mạch máu rất nhỏ, như trong quá trình tạo lớp tế bào nội mô mới sẽ xuất hiện nhiều lỗ tổn thương như thế.
Xác định vị trí đau của tạng: đường dẫn truyền đau tạng và đau thành
Cảm giác đau từ các tạng khác nhau thường khó xác định rõ vị trí. Thứ nhất, não không nhận thức được về sự hiện diện của các cơ quan. Thứ hai, cảm giác từ ổ bụng và lồng ngực được dẫn truyền lên hệ thần kinh trung ương qua hai con đường:
Thể tích máu của phổi: thể tích ở trạng thái bình thường và bệnh lý
Theo những tình trạng sinh lý và bệnh lý, số lượng máu trong phổi có thể khác nhau từ ít nhất một nửa bình thường lên đến gấp đôi bình thường. Khi thở dốc rất mạnh, tạo áp lực cao trong phổi, 250 ml máu có thể ra khỏi tuần hoàn phổi vào tuần hoàn toàn thân.
Cơ chế bệnh sinh của rối loạn tiêu hóa ruột non
Tình trạng thiếu bài tiết tuyến tụy thường xuyên xảy ra ở những người bị viêm tụy, khi ống tụy bị tắc do sỏi mật ở nhú Vater, hoặc sau khi đầu tụy bị cắt bỏ vì của bệnh ác tính.
Điều chỉnh tật khúc xạ bằng kính áp tròng và đục thể thủy tinh
Kính áp tròng có một vài ưu điểm và ngoài ra còn có đặc điểm như kính chuyển động đồng thời với mắt, kính áp tròng sẽ ảnh hưởng một ít đến kích thước thật của vật khi nhìn qua kính.
Chuyển hóa prothrombin thành thrombin: cơ chế đông máu cầm máu
Nếu gan không sản xuất được prothrombin thì nồng độ prothrombin trong huyết tương có thể hạ xuống quá thấp, không đáp ứng nhu cầu sử dụng cho quá trình đông máu.
Cơ chế cô đặc nước tiểu: những thay đổi áp suất thẩm thấu ở các đoạn khác nhau của ống thận
Sự giảm cô đặc do urê ít được tái hấp thu vào tủy kẽ từ các ống góp khi nồng độ ADH thấp và thận hình thành một khối lượng lớn nước tiểu pha loãng.
Chảy máu qúa mức: do thiếu các yếu tố đông máu
Chảy máu quá mức có thể từ sự thiếu bất kì yếu tố đông máu nào. Có ba thể hay gặp nhất sẽ được nói đến ở đây đó là: (1) thiếu vitamin K, (2) hemophila và (3) giảm tiểu cầu.
Mức lọc cầu thận bằng hai mươi phần trăm lưu lượng máu qua thận
Mức lọc cầu thận được quyết định bởi cân bằng thủy tĩnh và áp suất keo qua màng mao mạch hệ số lọc cầu thận, phụ thuộc tính thấm mao mạch cầu thận và diện tích.
Đại cương sinh lý bệnh lão hóa
Tăng nhạy cảm với bệnh tật, tăng nguy cơ tử vong: hầu hết cơ thể già mang một hoặc nhiều bệnh và có tỷ lệ tử vong cao nhất so với mọi giai đoạn phát triển trước đó.
Sinh lý bệnh soi sáng công tác dự phòng và điều trị
Sự hiểu biết về vai trò của nguyên nhân và điều kiện gây bệnh sẽ giúp cho việc đề ra kế hoạch phòng bệnh đúng.
Phản ứng trong truyền máu và cách xác định nhóm máu: quá trình ngưng kết
Thỉnh thoảng, khi truyền máu không hoà hợp, có thể gây ra sự tiêu máu trực tiếp. Trong trường hợp này, kháng thể li giải hồng cầu bằng cách kích thích hệ thống bổ thể, tiết ra enzim phân giải protein ở màng tê bào.
Động lực học của mao mạch phổi: trao đổi dịch mao mạch và động lực học dịch kẽ phổi
Phù phổi xảy ra cùng cách phù nề xảy ra ở những nơi khác trong cơ thể. Bất kì yếu tố làm tăng lọc dịch lỏng ra khỏi mao mạch phổi hoặc cản trở chức năng bạch huyết phổi và gây ra tăng áp lực lọc phổi kẽ từ âm sang dương.
Bài tiết nước tiểu cô đặc: nồng độ ADH cao và áp suất thẩm thấu cao vùng tủy thận
Các ống góp xung quanh kẽ tủy thận thường có áp suất thẩm thấu cao, vì vậy khi nồng độ ADH cao, nước di chuyển qua màng tế bào ống thận bằng cách thẩm thấu vào kẽ thận.
Điều chỉnh trao đổi dịch và cân bằng thẩm thấu dịch trong và ngoài tế bào
Sự trao đổi giữa dịch nội bào và ngoại bào chủ yếu dựa vào chênh lêch áp suất thẩm thấu của những chất tan như Na, K, Cl.
