- Trang chủ
- Sách y học
- Bài giảng sinh lý bệnh
- Kiểm soát áp suất thẩm thấu và nồng độ natri: cơ chế osmoreceptor-ADH và cơ chế khát
Kiểm soát áp suất thẩm thấu và nồng độ natri: cơ chế osmoreceptor-ADH và cơ chế khát
Trong trường hợp không có các cơ chế ADH-khát, thì không có cơ chế feedback khác có khả năng điều chỉnh thỏa đáng nồng độ natri huyết tương và áp suất thẩm thấu.
Biên tập viên: Trần Tiến Phong
Đánh giá: Trần Trà My, Trần Phương Phương
Ở một người khỏe mạnh, các cơ chế osmoreceptor-ADH và cơ chế khát làm việc song song để điều chỉnh một cách chính xác áp suất thẩm thấu dịch ngoại bào và nồng độ natri, bất chấp những thách thức liên tục của tình trạng mất nước. Ngay cả với những thách thức thêm vào, chẳng hạn như lượng muối vào cao, các hệ thống feedback này có năng lực giữ độ thẩm thấu huyết tương hợp lý không đổi. Hình cho thấy rằng một sự gia tăng lượng natri vào cao bằng 6 lần bình thường chỉ có một ảnh hưởng nhỏ đến nồng độ natri huyết tương trong khi các cơ chế ADH và cơ chế khát đều hoạt động bình thường.
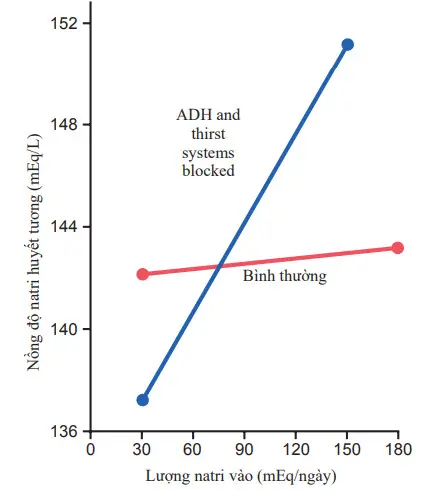
Hình. Ảnh hưởng của những thay đổi lớn về lượng natri ăn vào đối với nồng độ natri trong dịch ngoại bào ở chó trong điều kiện bình thường (đường màu đỏ) và sau khi hệ thống phản hồi cơn khát và hormone chống bài niệu (ADH) bị chặn (đường màu xanh). Lưu ý rằng việc kiểm soát nồng độ natri trong dịch ngoại bào kém khi không có các hệ thống phản hồi này.
Khi 1 trong 2 cơ chế hoặc cơ chế ADH hoặc cơ chế khát suy yếu, thì cơ chế còn lại thông thường vẫn có thể kiểm soát áp suất thẩm thấu ngoại bào và nồng độ natri với hiệu quả hợp lý, miễn là có đủ lượng dịch vào để cân bằng với khối lượng nước tiểu bắt buộc hàng ngày và sự mất nước gây ra bởi sự hô hấp, sự ra mồ hôi, hoặc đường tiêu hóa. Tuy nhiên, nếu cả hai cơ chế ADH và cơ chế khát thất bại đồng thời, thì nồng độ natri huyết tương và áp suất thẩm thấu khó được khó kiểm soát; do đó, khi lượng natri vào tăng lên sau khi ngăn chặn toàn bộ hệ thống ADH-khát, thì có những thay đổi tương đối lớn trong nồng độ natri huyết tương xảy ra.
Trong trường hợp không có các cơ chế ADH-khát, thì không có cơ chế feedback khác có khả năng điều chỉnh thỏa đáng nồng độ natri huyết tương và áp suất thẩm thấu.
Vai trò của angiotensin II và aldosteron trong kiểm soát áp suất thẩm thấu dịch ngoại bào và nồng độ natri
Cả angiotensin II và aldosterone đóng một vai trò quan trọng trong việc điều chỉnh sự tái hấp thu natri bởi các ống thận. Khi lượng natri vào thấp, làm tăng nồng độ của các hormone này kích thích sự tái hấp thu natri bởi thận và do đó ngăn ngừa sự sự mất mát lớn natri, mặc dù lượng natri vào có thể giảm xuống thấp tới 10% so với bình thường. Ngược lại, với lượng natri vào cao, làm giảm sự hình thành của các hormone này cho phép thận bài xuất một lượng lớn natri.
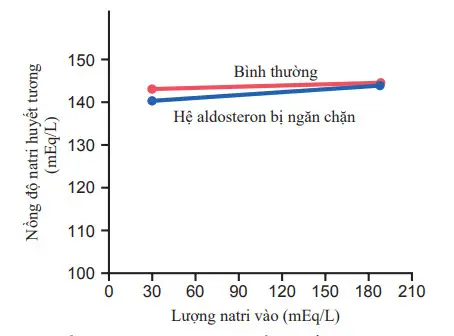
Hình. Ảnh hưởng của những thay đổi lớn về lượng natri ăn vào đối với nồng độ natri trong dịch ngoại bào ở chó trong điều kiện bình thường (vạch đỏ) và sau khi hệ thống phản hồi aldosteron bị chặn (vạch xanh). Lưu ý rằng nồng độ natri được duy trì tương đối ổn định trong phạm vi lượng natri lớn này, có hoặc không có kiểm soát phản hồi aldosterone.
Bởi vì tầm quan trọng của angiotensin II và aldosteron trong việc điều chỉnh sự bài xuất natri bởi thận, một người có thể suy luận sai lầm rằng chúng cũng đóng một vai trò quan trọng trong việc điều chỉnh nồng độ natri dịch ngoại bào. Mặc dù các hormone này làm tăng một lượng natri trong dịch ngoại bào, chúng cũng làm tăng thể tích dịch ngoại bào bằng cách gia tăng sự tái hấp thu nước cùng với natri. Do đó, angiotensin II và aldosteron có ít ảnh hưởng đến nồng độ natri, ngoại trừ dưới những điều kiện khắc nghiệt.
Sự không quan trọng tương đối này của aldosterone trong việc điều chỉnh nồng độ natri dịch ngoại bào được thể hiện bởi thí nghiệm trong hình. Hình này cho thấy sự ảnh hưởng lên nồng độ natri huyết tương của những thay đổi lượng natri vào nhiều hơn gấp sáu lần với hai điều kiện: (1) dưới các điều kiện bình thường và (2) sau khi hệ thống feedback aldosterone bị chặn lại bằng cách loại bỏ các tuyến thượng thận và truyền cho các động vật aldosterone ở một tốc độ không đổi sao cho nồng độ huyết tương không thể tăng hoặc giảm. Lưu ý rằng khi lượng natri vào đã tăng gấp sáu lần, nồng độ huyết tương thay đổi chỉ khoảng 1-2% trong cả hai trường hợp. Sự phát hiện này cho thấy rằng thậm chí không có một hệ thống feedback chức năng aldosterone, nồng độ natri huyết tương có thể được điều chỉnh tốt. Các thí nghiệm cùng loại đã được tiến hành sau khi ngăn chặn sự hình thành angiotensin II, cho kết quả tương tự.
Có hai lý do chính giải thích tại sao những thay đổi của angiotensin II và aldosteron không có một ảnh hưởng lớn đến nồng độ natri huyết tương. Thứ nhất, như đã thảo luận trước đó, angiotensin II và aldosteron làm tăng cả sự tái hấp thu natri và sự tái hấp thu nước bởi các ống thận, dẫn đến làm tăng khối lượng dịch ngoại bào và số lượng natri nhưng ít thay đổi nồng độ natri. Thứ hai, miễn là cơ chế ADH-khát có chức năng, bất cứ khuynh hướng nào thiên về gia tăng nồng độ natri huyết tương được đền bù bằng cách gia tăng lượng nước vào hoặc gia tăng sự bài tiết ADH huyết tương, điều đó có xu hướng pha loãng dịch ngoại bào trở về bình thường. Hệ thống ADH-khát làm lu mờ nhiều các hệ thống angiotensin II và aldosteron trong điều hoà nồng độ natri dưới những điều kiện bình thường. Ngay cả ở những bệnh nhân cường aldosteron nguyên phát, những người có mức aldosterone vô cùng cao, nồng độ natri huyết tương thường xuyên tăng chỉ khoảng 3-5 mEq / L trên mức bình thường.
Dưới những điều kiện khắc nghiệt gây ra bởi sự mất hoàn toàn của sự bài tiết aldosterone giống như kết quả của sự cắt bỏ tuyến thượng thận hoặc ở các bệnh nhân bị bệnh Addison (suy giảm nghiêm trọng sự bài tiết hoặc thiếu toàn bộ aldosterone), có sự mất mát to lớn natri qua thận, điều đó có thể dẫn đến sự suy giảm nồng độ natri huyết tương. Một trong những lý do cho điều này là sự mất mát lớn này của natri cuối cùng gây ra sự suy kiệt nghiêm trọng thể tích dịch và làm giảm huyết áp, điều này có thể kích hoạt cơ chế khát thông qua các phản xạ tim mạch. Sự kích hoạt này dẫn đến một sự pha loãng hơn nữa của nồng độ natri trong huyết tương, mặc dù sự gia tăng lượng nước vào giúp giảm đến mức tối thiểu sự sụt giảm thể tích dịch cơ thể trong những điều kiện này.
Do đó, những tình huống cực độ là tồn tại trong đó nồng độ natri huyết tương có thể thay đổi đáng kể, ngay cả với một cơ chế chức năng ADH-khát. Mặc dù vậy, cơ chế ADH-khát cho đến nay là hệ thống feedback mạnh mẽ nhất trong cơ thể trong kiểm soát áp suất thẩm thấu dịch ngoại bào và nồng độ natri.
Cơ chế thèm muối trong kiểm soát nồng độ natri dịch ngoại bào và thể tích dịch ngoại bào
Sự duy trì thể tích dịch ngoại bào và nồng độ natri bình thường đòi hỏi một sự cân bằng giữa sự bài xuất natri và lượng natri vào. Trong những nền văn minh hiện đại, lượng natri vào là hầu như luôn luôn lớn hơn mức cần thiết cho sự cân bằng nội môi. Trong thực tế, lượng natri vào trung bình cho một người trong các nền văn hóa công nghiệp hóa, người ăn các thực phẩm đã chế biến, thường khoảng giữa 100 và 200 mEq / ngày, mặc dù con người có thể tồn tại và hoạt động bình thường trong khi sự nhập vào chỉ 10 đến 20 mEq / ngày. Vì vậy, hầu hết mọi người ăn quá nhiều natri hơn mức cần thiết cho sự cân bằng nội môi, và bằng chứng chỉ ra rằng lượng natri vào cao thường xuyên của chúng ta có thể góp phần vào các rối loạn tim mạch như cao huyết áp.
Sự thèm muối là do một phần trong thực tế các loài động vật và con người thích muối và ăn nó bất kể họ có thiếu muối hay không. Sự thèm muối cũng có một thành phần điều hoà trong đó có một đợt vận động hành vi để thu được muối khi một sự thiếu hụt natri tồn tại trong cơ thể. Sự vận động hành vi này là đặc biệt quan trọng trong các động vật ăn cỏ, chúng vốn ăn một chế độ ăn ít natri, nhưng sự thèm muối cũng có thể quan trọng ở những người có một sự thiếu hụt nghiêm trọng natri, chẳng hạn như xảy ra trong bệnh Addison. Trong trường hợp này, có một sự thiếu hụt bài tiết aldosterone, điều đó gây ra sự mất mát quá mức natri trong nước tiểu và dẫn đến giảm thể tích dịch ngoại bào và giảm nồng độ natri; cả những thay đổi này gợi ra sự thèm muối.
Nói chung, các kích thích chính làm tăng sự thèm muối có liên quan với sự thiếu hụt natri và sự giảm thể tích máu hay sự giảm huyết áp liên quan đến sự suy tuần hoàn.
Cơ chế thần kinh cho sự thèm muối tương tự với cơ chế khát. Một số trong những trung tâm thần kinh tương tự nhau ở khu vực AV3V của não bộ dường như có liên quan bởi vì những tổn thương trong khu vực này thường xuyên ảnh hưởng đến cả sự khát nước và sự thèm muối đồng thời ở động vật. Ngoài ra, các phản xạ tuần hoàn được gợi ra bởi huyết áp thấp hoặc sự giảm khối lượng máu ảnh hưởng đến cả sự khát nước và sự thèm muối tại cùng một thời điểm.
Bài viết cùng chuyên mục
Thuốc chẹn kênh natri: giảm tái hấp thu natri ở ống góp
Sự giảm hoạt động của bơm Natri-Kali-ATP làm giảm vận chuyển Kali vào trong tế bào và do đó làm giảm bài tiết Kali vào dịch trong lòng ống thận. Vì lí do này, thuốc chẹn kênh Natri còn được gọi là lợi tiểu giữ kali, và giảm tỷ lệ bài tiết kali ra nước tiểu.
Ống thận: sự bài thiết H+ và sự tái hấp thu HCO3-
Khoảng 80-90% HCO3- tái hấp thu (và H+ bài tiết) được thực hiện ở ống lượn gần, chỉ một số ít HCO3- xuống ống lượn xa và ống góp. Ở đoạn dày của nhánh lên quai Henle, khoảng 10% HCO3- nữa được tái hấp thu, và phần còn lại được hấp thu ở ống lượn xa và ống góp.
Bệnh tim: tăng khối lượng máu và khối lượng dịch ngoại bào
Nếu suy tim không quá nặng, sự gia tăng thể tích máu thường có thể đưa cung lượng tim trở lại và áp lực động mạch hầu như trở về bình thường và bài tiết natri cuối cùng sẽ tăng trở lại bình thường.
Tăng thông khí phổi: giảm nồng độ H+ dịch ngoại bào và làm tăng pH
Nếu chuyển hóa tạo CO2 vẫn không đổi, chỉ có các yếu tố ảnh hưởng đến pCO2 trong dịch ngoại bào là tốc độ thông khí ở phổi. Thông khí phế nang càng cao, pCO2 càng thấp.
Giảm mức lọc cầu thận: tăng áp suất thủy tĩnh của khoang Bowman
Trong trạng thái bệnh nào đó liên quan đến cấu trúc đường tiểu, áp lực khoang Bowman’s có thể tăng rõ rệt, gây ra giảm trầm trọng mức lọc cầu thận.
Thuốc lợi tiểu: các loại và cơ chế tác dụng
Tác dụng lâm sàng chủ yếu của các thuốc lợi tiểu là làm giảm lượng dịch ngoại bào, đặc biệt trong những bệnh có kèm theo phù và tăng huyết áp.
Chống đông: những chất dùng trong lâm sàng
Trong một số trường hợp cần kìm hãm quá trình đông máu. Có nhiều chất có tác dụng chống đông trong đó hay dùng nhất là heparin và coumarin.
Kích thích tiết ADH: tầm quan trọng của độ thẩm thấu và phản xạ tim mạch
Với sự giảm thể tích máu, nồng độ ADH nhanh chóng tăng lên. Như vậy, với mức giảm nghiêm trọng về thể tích máu, các phản xạ tim mạch đóng một vai trò quan trọng trong việc kích thích sự bài tiết ADH.
Đông máu nội mạch rải rác: tắc nghẽn mạch máu nhỏ ở ngoại vi
Sự tắc nghẽn các mạch máu nhỏ ngoại vi sẽ ngăn cản mô nhận oxy và các chất dinh dưỡng khác, điều này sẽ dẫn đến hoặc làm nặng thêm tình trạng shock tuần hoàn.
Cơ chế thận bài tiết nước tiểu pha loãng
Qúa trình pha loãng đạt được bằng cách tái hấp thu các chất tan đến một mức độ lớn hơn so với nước, nhưng điều này chỉ xảy ra trong các phân đoạn nhất định của hệ thống ống thận.
Ảnh hưởng cấp tính của suy tim mức độ trung bình
Khi cung lượng tim giảm tạm thời, nhiều phản xạ tuần hoàn nhanh chóng được kích hoạt. Phản xạ được biết đến nhiều nhất là phản xạ thụ thể áp lực, được kích hoạt khi áp lực tâm nhĩ thay đổi.
Tăng chức năng tuyến thượng thận và hội chứng Cushing
Tiết ACTH quá mức là nguyên nhân thường gặp nhất của hội chứng Cushing và được đặc trưng bởi nồng độ cao ACTH và cortisol trong huyết tương.
Một số chỉ định điều trị shock
Bởi vì tác động có hại chính của hầu hết các loại shock là phân phối quá ít oxy đến các mô, việc cho bệnh nhân thở oxy có thể có lợi trong một số trường hợp.
Dịch trong khoang màng phổi: áp lực âm giữ cho phổi nở và lượng dịch màng phổi
Khi dịch nhiều hơn đủ để bắt đầu chảy trong khoang màng phổi thì các dịch dư thừa bị bơm đi bằng cách mở trực tiếp mạch bạch huyết từ khoang màng phổi vào trung thất, trên bề mặt cơ hoành và xung quanh màng phổi thành.
Hệ thống bổ thể và hoạt động của kháng thể
Khi một kháng thể liên kết với một kháng nguyên, một vị trí phản ứng đặc hiệu trên của kháng thể bị phát hiện, hoặc hoạt hóa, và gắn trực tiếp với phân tử C1 của hệ thống bổ thể.
Suy tim mất bù: những thay đổi huyết động học trong suy tim nặng
Khi phát hiện tình trạng mất bù nghiêm trọng bằng tăng phù, đặc biệt là phù phổi, dẫn đến ran nổ và khó thở. Thiếu điều trị phù hợp trong giai đoạn cấp này có thể dẫn đến tử vong.
Khả năng giãn nở của phổi: ảnh hưởng của lồng ngực
Lồng ngực có khả năng đàn hồi và dẻo, tương tự như phổi, thậm chí nếu phổi không hiện diện trong ngực, cơ hỗ trợ sẽ vẫn giúp lồng ngực giãn nở.
Viêm cầu thận mạn: nguyên nhân do tổn thương cầu thận
Viêm cầu thận mạn thường khởi phát với sự tăng lắng đọng các phức hợp kháng nguyên kháng thế ở màng đáy cầu thận. Viêm cầu thận cấp, số lượng bệnh nhân nhiễm liên cầu chỉ chiếm một phần nhỏ trong tổng số bệnh nhân bị viêm cầu thận mạn.
Định lượng bài tiết acid base qua thận
Để cân bằng acid-base, lượng acid bài tiết thuần phải bằng lượng acid sản xuất không bay hơi trong cơ thể. Trong nhiễm toan, acid bài tiết thuần tăng rõ rệt, đặc biệt do tăng tiết NH4+, do đó loại bỏ acid ra khỏi máu.
Các nguyên nhân rối loạn cân bằng acid base trên lâm sàng
Cách điều trị tốt nhất cho nhiễm acid hoặc nhiễm kiềm là điều chỉnh lại tình trạng gây ra sự bất thường. Điều này thường rất khó, đặc biệt đối với các bệnh mạn tính làm suy yếu chức năng của phổi hoặc gây ra suy thận.
Hiểu biết toàn diện cơ chế bệnh sinh của béo phì
Nguy cơ béo phì ảnh hưởng đến nhiều bệnh lý khác nhau như xơ gan, tăng huyết áp, bệnh lý tim mạch, đột quỵ, và bệnh thận xuất hiện liên quan nhiều tới béo tạng (béo bụng) hơn là tăng dự trữ mỡ dưới da, hoặc dự trữ chất béo phần thấp cơ thể như là hông.
Huyết khối: nguy cơ gây tắc mạch nghiêm trọng
Nguyên nhân tạo nên huyết khối thường là bề mặt nội mô của mạch máu xù xì có thể gây ra bởi xơ vữa động mạch, nhiễm trùng hay chấn thương và tốc độ chảy rất chậm của máu trong lòng mạch.
Bệnh van động mạch chủ: ảnh hưởng của huyết động học trong hẹp và hở van
Lượng bù trừ quan trọng được diễn ra có thể cải thiện mức độ nghiêm trọng của các khuyết tật tuần hoàn. Một số cơ chế bù trừ được miêu tả.
Phù ở bệnh nhân suy tim
Suy tim cấp nghiêm trọng thường gây giảm huyết áp mao mạch ngoại vi. Do đó, thử nghiệm trên động vật, cũng như thử nghiệm ở người, cho thấy suy tim cấp hầu hết không gây phù ngoại vi ngay lập tức.
Hấp thụ và bài tiết natri: được cân bằng trong trạng thái ổn định
Nếu rối loạn chức năng thận không quá nghiêm trọng, có thể đạt được cân bằng natri chủ yếu bằng cách điều chỉnh nội thận với những thay đổi tối thiểu về thể tích dịch ngoại bào hoặc các điều chỉnh toàn thân khác.
